「オプジーボ」の独壇場だった免疫チェックポイント阻害薬の市場。きょう2月15日、競合となる「キイトルーダ」が発売され、競争の火ぶたが切られました。
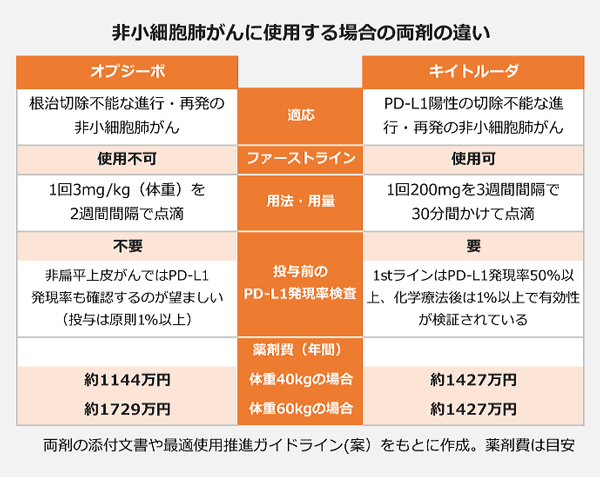
注目された薬価は同額。主戦場となる非小細胞肺がんでは、キイトルーダがファーストラインにも使える一方、投与患者はPD-L1陽性に限定。対するオプジーボは、化学療法後の患者にしか使えないものの、PD-L1の発現率に関わらず使うことができます。
オプジーボが先行の利を生かすのか、キイトルーダが追い上げるのか。両剤の違いから、競争の行方を展望します。
年間1427万円…注目の薬価 1日当たりで同額に
小野薬品工業の「オプジーボ」に、いよいよ競合品の登場です。きょう2月15日、オプジーボと同じ抗PD-1抗体の「キイトルーダ」(MSD)が発売され、競争の幕が上がりました。
「キイトルーダ」は昨年9月、悪性黒色腫の適応で承認を取得。本来なら昨年11月に薬価収載されるはずでしたが、「オプジーボ」の薬価引き下げをめぐる議論に決着がついておらず、MSDが発売を先送り。その間に非小細胞肺がんへの適応拡大も承認され、今回、満を持しての発売となりました。
注目された薬価は、20mg0.8mL1瓶が8万4488円、100mg4mL1瓶が41万541円。1日当たりの薬価は3万9099円で、「オプジーボ」と同額に設定されました。仮に1年間使い続けたとすると、1427万円かかる計算。「オプジーボ」で問題視された海外との比較では、米国やドイツに比べて低い水準となりました。
「オプジーボ」は現在、悪性黒色腫と非小細胞肺がん、腎細胞がん、古典的ホジキンリンパ腫の4つの適応で承認済み。2016年度の売上高は1050億円を見込んでいます。一方、「キイトルーダ」の適応は今のところ悪性黒色腫と非小細胞肺がんの2つで、ピーク時に544億円の売り上げを予想。MSDはがん領域に強い大鵬薬品工業との提携で、早期の市場浸透を狙います。

「1stライン」「PD-L1で絞り込み」肺がん市場 競争の行方は?
市場規模も大きく、当面、競争の主戦場となるであろう非小細胞肺がんの適応について、さらに詳しく見ていきます。
競争の行方を占う上でポイントとなるのが、両剤の2つの大きな違い。1つは、ファーストライン(化学療法未治療の患者に最初の抗がん剤として使用すること)の適応を持っているかどうか。もう1つは、PD-L1の発現率によって投与患者が限定されるかどうか、です。
1stライン キイトルーダは可 オプジーボは不可
ファーストラインでの使用は、「キイトルーダ」が可能なのに対し、「オプジーボ」は現段階では不可。昨年、欧州臨床腫瘍学会で発表された臨床第3相試験の結果で、明暗がくっきりと分かれました。
「キイトルーダ」は未治療の非小細胞肺がん患者(PD-L1発現率50%以上)を対象に行った「KEYNOTE-024試験」で、化学療法に比べて無増悪生存期間(PFS)を有意に延長し、病勢進行のリスクを50%低減。MSDは規制当局にこの試験結果を追加で提出し、昨年12月、ファーストラインでの使用も含めて非小細胞肺がんの適応を取得しました。
一方、「オプジーボ」は同じく未治療患者を対象とした「CheckMate-026試験」で化学療法に対する優越性を示すことができず、試験は失敗。ファーストランでの有効性を探る別の臨床試験も進行中ですが、現時点では適応を取れておらず、化学療法を行った後でしか使うことができません。
キイトルーダ PD-L1発現率で患者絞り込み
先行を許す「キイトルーダ」にとって、ファーストランでの使用が認められたことは、対象となる患者数が多くなるという点で「オプジーボ」に対する大きなアドバンテージ。ただ、「キイトルーダ」がファーストラインでの需要を全て取り込むことができるわけではありません。腫瘍細胞にPD-L1がどれだけ発現しているかで、投与対象となる患者が限定されるからです。
PD-L1とは、腫瘍細胞の表面に発現するタンパク質で、これが免疫細胞のPD-1と結合すると、免疫細胞による腫瘍細胞への攻撃にブレーキがかかります。抗PD-1抗体はPD-1とPD-L1の結合を阻害することでこのブレーキを外し、免疫細胞の攻撃力を回復させる薬剤です。
非小細胞肺がんを対象とした「キイトルーダ」のこれまでの臨床試験では、ファーストラインの場合はPD-L1発現率50%以上の患者(KEYNOTE-024試験)、化学療法後の場合はPD-L1発現率1%以上の患者(KEYNOTE-010試験)で、それぞれ有効性が確認されています。
このため「キイトルーダ」の投与には「PD-L1陽性」とのしばりがつきました。投与前には、その可否を判断するためにPD-L1の発現率を調べる検査を行わなければなりません。
ファーストラインで「キイトルーダ」の投与の対象となるPD-L1高発現の患者は、進行性非小細胞肺がんの3割程度。しかもその中には、EGFR遺伝子変異陽性やALK融合遺伝子変異陽性など、別の分子標的薬が第一選択となる患者も含まれます。ファーストラン適応が認められたことによるアドバンテージは、それほど大きいというわけでもなさそうです。
対する「オプジーボ」は、非扁平上皮がん(非小細胞肺がんの一種)に投与する場合にはPD-L1発現率も確認することが望ましいとされていますが、基本的には事前の検査は不要です。化学療法後の部分では、「オプジーボ」の方が対象患者は広くなります。
「オプジーボ」はすでに1万1000人以上の非小細胞肺がん患者に使用されており、実臨床での使用実績は大きな強み。ファーストラインの適応はないものの、先行の利は小さくありません。
オプジーボ 体重増えるほど高額に
「キイトルーダ」の薬価は「オプジーボ」と1日当たりの薬価が同額になるように設定されましたが、薬剤費は必ずしも同じというわけではありません。
非小細胞肺がんの場合、「オプジーボ」の用法・用量は「1回3mg/kgを2週間間隔」で、体重が重くなると投与量も増えるのに対し、「キイトルーダ」は体重に関わらず投与量は1回200mgと決まっています。
例えば、「オプジーボ」を体重40kgの非小細胞肺がん患者に投与すると年間1144万円、60kgなら年間1729万円かかりますが、「キイトルーダ」は年間1427万円で変わりません。日本人の平均体重を考えると、「キイトルーダ」の方が安く済む場合が多そうです。
高額療養費制度もあり、患者の自己負担はどちらを使ってもほとんど変わらないとみられますが、高額な薬剤が公的医療保険財政に与える影響が懸念される中、こうした薬剤費の違いが医師の薬剤選択を左右するかどうかも注目されるところです。
世界売上高はオプジーボが圧倒 さらなる競合品も
両剤の世界売上高を見てみると、16年は米ブリストル・マイヤーズスクイブの「オプジーボ」が37億7400万ドル(約4265億円)、米メルクの「キイトルーダ」が14億200万ドル(約1584億円)。「オプジーボ」は14年7月に日本、「キイトルーダ」は14年9月に米国と、ほぼ同じ時期に世界で最初の承認を取得しましたが、売上高は2.7倍の差がついています。
「キイトルーダ」の登場で本格的な競争に突入した免疫チェックポイント阻害薬の市場ですが、後に続く製品も開発の最終段階に差し掛かっています。
「オプジーボ」と「キイトルーダ」が免疫細胞側のPD-1を阻害するのに対し、腫瘍細胞側のPD-L1を阻害する抗PD-L1抗体は、中外製薬とアストラゼネカ、メルクセローノとファイザーの連合がそれぞれ開発中です。
スイス・ロシュが創製した中外のアテゾリズマブは、尿路上皮がんと非小細胞肺がんの適応で年内に申請予定。アストラゼネカのデュルバルマブは非小細胞肺がんでP3、メルクセローノとファイザーのアベルマブは、卵巣がんと尿路上皮がんでP2/3試験が行われています。
アストラゼネカはブリストルの「ヤーボイ」と同じ抗CTLA4抗体のトレメリルマブも開発中。非小細胞肺がんなどを対象に、デュルバルマブとの併用療法の臨床試験を進めています。「オプジーボ」と「ヤーボイ」も複数のがん種で併用療法の開発を行っています。
こうした製品が来年以降、続々と発売されることで、免疫チェックポイント阻害薬をめぐる競争はさらに激しくなりそうです。
【AnswersNews編集部が製薬会社を分析!】 |