世界の製薬企業が実施している核酸医薬の臨床試験141件のうち、日本の製薬企業によるものは7件で、欧米勢に大きく後れをとっている――。こうした現状が、特許庁がまとめた調査報告書で明らかになりました。
抗体医薬の波に乗り遅れ、欧米製薬企業に大きく引き離された苦い経験を持つ日本の製薬企業。低分子医薬品と抗体医薬に続く第3世代の医薬品として核酸医薬が期待を集める中、抗体医薬の二の舞となることも懸念されています。
急拡大が予想される核酸医薬市場
核酸医薬とは、文字通りDNAやRNAを使った医薬品で、疾患に関係するタンパク質をつくる遺伝子に直接作用します。疾患に関わるタンパク質をたたく低分子薬や抗体医薬とは異なり、核酸医薬がターゲットとするのはタンパク質の合成そのもの。DNAから遺伝情報をコピーして運ぶmRNA(メッセンジャーRNA)を分解したり、mRNAの遺伝情報を読み取れなくしたりして、疾患に関係するタンパク質の合成を防ぎます。
核酸医薬は、特異性が高く副作用が出にくいとされ、化学合成ができるため安価に製造することも可能です。低分子薬や抗体医薬では治療が難しかった疾患の治療が可能になると期待されています。
20年度に5000億円市場に
現在、日米欧のいずれかで承認されている核酸医薬は、ファイザーの加齢黄斑変性治療薬「マクジェン」など3品目(日本では「マクジェン」1品目)だけで、本格的な市場形成はこれからと言われています。
市場調査・コンサルタント会社のシード・プランニングが2011年にまとめた調査報告書によると、10年に20億円だった核酸医薬の世界市場は、20年には5000億円に達する見通し。同社は、20年以降にはブロックバスターになる核酸医薬も出てくるとしており、抗体医薬と同じように市場が急速に拡大する可能性も高いと推測しています。
世界で141件の臨床試験が進行中…日本企業はわずか7件
低分子、抗体に続く第3世代の医薬品として有望視される核酸医薬の開発競争は、世界レベルで加速しています。しかし、日本の製薬企業は欧米勢に大きく後れをとっているのが現状です。
特許庁がまとめた「2015年度特許出願技術動向調査報告書」によると、15年10月時点で世界43社が141件の核酸医薬に関する臨床試験を行っていました。実施企業の国籍別に見ると、米国企業が99件(70.2%)、欧州企業が21件(14.9%)を占め、日本企業はわずか7件(5%)。試験を行っている企業は米国が24社に上ったのに対し、日本は4社にとどまっています。
進行中の臨床試験141件のうち、臨床第3相(P3)試験の段階にあるのは18件ですが、このうち15件は米国企業によるものでした。欧州企業は2件、日本企業は1件で、米国企業中心の市場形成を予測させる結果となっています。
特許出願は米国の5分の1、論文発表は低迷
核酸医薬に関する特許の出願でも、米国は他国を圧倒しています。
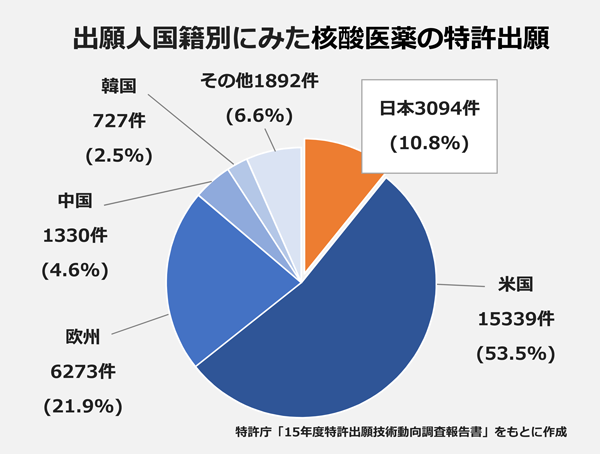
1980~2013年に日米欧中韓に出願された核酸医薬に関する特許2万8655件のうち、出願人が米国籍となっているのは半数を占める1万5339件。日本は3094件で、国別では米国に次ぐ出願を行っていますが、全体に占める割合は10.8%。米国に大きな差をつけられています。
出願人別の特許出願件数ランキングでは、米国のベンチャー企業が1、2位を独占するなど多数ランクインし、米国のベンチャー企業が開発競争をリードしていることを印象付ける結果に。一方、3位にスイス・ノバルティス、4位に仏サノフィ、6位にスイス・ロシュ、8位に米ファイザーが入るなど、欧米の大手製薬企業の動きも目立ちます。
日本勢は7位のオンコセラピー・サイエンスが最高。14位に日東電工、30位に第一三共が入りましたが、上位陣には大きく差をつけられています。
論文件数は日本だけが減少
各国の創薬力を図る重要な指標の1つとなる論文発表件数を見ると、さらに深刻な状況が浮かび上がってきます。
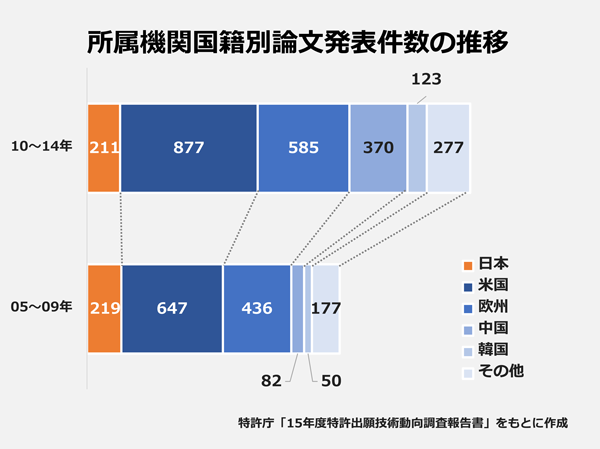
05~14年に世界で発表された核酸医薬に関する論文のうち、調査で解析対象となった4054件を研究者の所属機関の国籍別に見ると、トップとなったのは米国で発表論文数は1524件。2位は中国(452件)、3位は日本(430件)で、ドイツ(237件)、韓国(173件)、カナダ(154件)と続きました。米国は論文発表件数でも他国を大きく引き離しています。
所属機関の国籍別の論文発表件数を05~09年、10~14年の2つに分け、その推移を追ったのが下のグラフです。米欧中韓は論文発表件数が増え、特に中国の増加が顕著ですが、日本は唯一、発表件数が減少。05~09年に13.5%だったシェアは、10~14年には8.6%まで低下しました。
日本勢の動きは?
こうして見ると、日本は核酸医薬の開発で欧米に大きく水をあけられており、特に米国との間には歴然とした差があることが分かります。「抗体医薬の二の舞になる恐れがある」と危惧する声も上がる中、日本勢はどう動いているのでしょうか。
アンジェスMG、アトピー薬を今年申請予定
特許庁の調査報告書によると、核酸医薬の臨床試験を行っているのは、第一三共と日本新薬、アンジェスMG、日東電工の4社。第一三共と日本新薬は、デュシェンヌ型筋ジストロフィーの治療薬を開発中で、日本新薬の「NS-065/NCNP-01」は先駆け審査指定制度の対象品目に指定されました。日東電工が肝線維症や肝硬変を対象に開発している「ND-L02-s0201」は、米国でファスト・トラック(優先審査)の指定を受けています。
最も開発が進んでいるのは、アンジェスMGの「AMG0101」。アトピー性皮膚炎を対象とした軟膏剤で、国内で臨床第3相試験を実施中。順調にいけば、16年に承認申請を行う予定といいます。
国立がん研究センターでは、治療抵抗性乳がんに対する核酸医薬をスリー・ディー・マトリックスと共同開発。昨年6月から医師主導治験が行われています。
ベンチャーと大手の提携も活発化
ベンチャー企業と大手企業の提携も活発になってきました。
今年1月には、東レがバイオベンチャーのボナックから特発性肺線維症に対する核酸医薬の開発・販売権を取得。昨年2月には中外製薬とナノキャリアが共同研究契約を結びました。武田薬品工業や大塚製薬、塩野義製薬、大正製薬などが、内外のベンチャーと組んで研究開発を進めています。
「挽回可能なチャンスはある」
核酸医薬の開発は米国のベンチャー企業を中心に急速に進展していますが、承認に漕ぎ着けられたのはまだ3品目だけ。昨年11月と今年4月には、米国企業が開発したデュシェンヌ型筋ジストロフィーに対する核酸医薬について、米FDA(食品医薬品局)の諮問委員会が承認に待ったをかけるなど、本格的な実用化にはまだ高いハードルがあります。
特許庁の報告書によれば、抗体医薬は特許出願件数約3万5000件(1971~2012年)に対して52品目が承認(14年末時点)されている一方、核酸医薬は特許出願約2万9000件(1980~2013年)に対して3品目の承認(15年末時点)にとどまります。
核酸医薬は抗体医薬に比べ、特許出願件数に対する承認品目数の比率が極端に小さく、特許庁は「現時点での特許出願件数や臨床開発件数の差異が、そのまま市場競争力に結びつくものではなく、今後の取り組みにより(日本勢にも)十分挽回可能なチャンスがある」と結論付けています。
抗体医薬での出遅れには、多くの製薬企業が参入に及び腰だったことに加え、産学連携の不足、国家レベルの研究開発戦略の不在、ガイドラインなど新技術に対する国の対応の遅れなどが背景にあったと指摘されています。
核酸医薬で日本が欧米勢に追いつき、存在感を示していくためには、抗体医薬と同じ轍を踏まぬよう、産官学が連携して体制整備を行っていくことが重要です。