
約100人に1人が発症すると言われる統合失調症。新薬開発の難易度が高いこの疾患に昨年、米国でムスカリン受容体M1/M4を標的とする新規作用機序の治療薬「Cobenfy」(米ブリストル)が承認されました。ネクセラファーマが創製したM4作動薬も今年、開発の最終段階に入る見通し。大塚製薬はTAAR1アゴニスト・ウロタロントの追加の臨床第3相(P3)試験を先月開始するなど、新薬開発が活発化しています。
Cobenfyはムスカリン受容体標的
統合失調症は、およそ100人に1人が発症する精神疾患です。国内の患者数は約80万人、世界では約2400万人に上るとされ、患者の多くは10代から30代にかけて発症します。主な症状は、▽幻覚や妄想などの陽性症状▽意欲減退や感情の平板化といった陰性症状▽注意力や記憶力の低下、実行能力の低下といった認知機能障害――の3つ。治療の中心は薬物療法と心理社会的療法で、治療や休息を通じて患者は臨床的・機能的・個人的な回復を目指します。
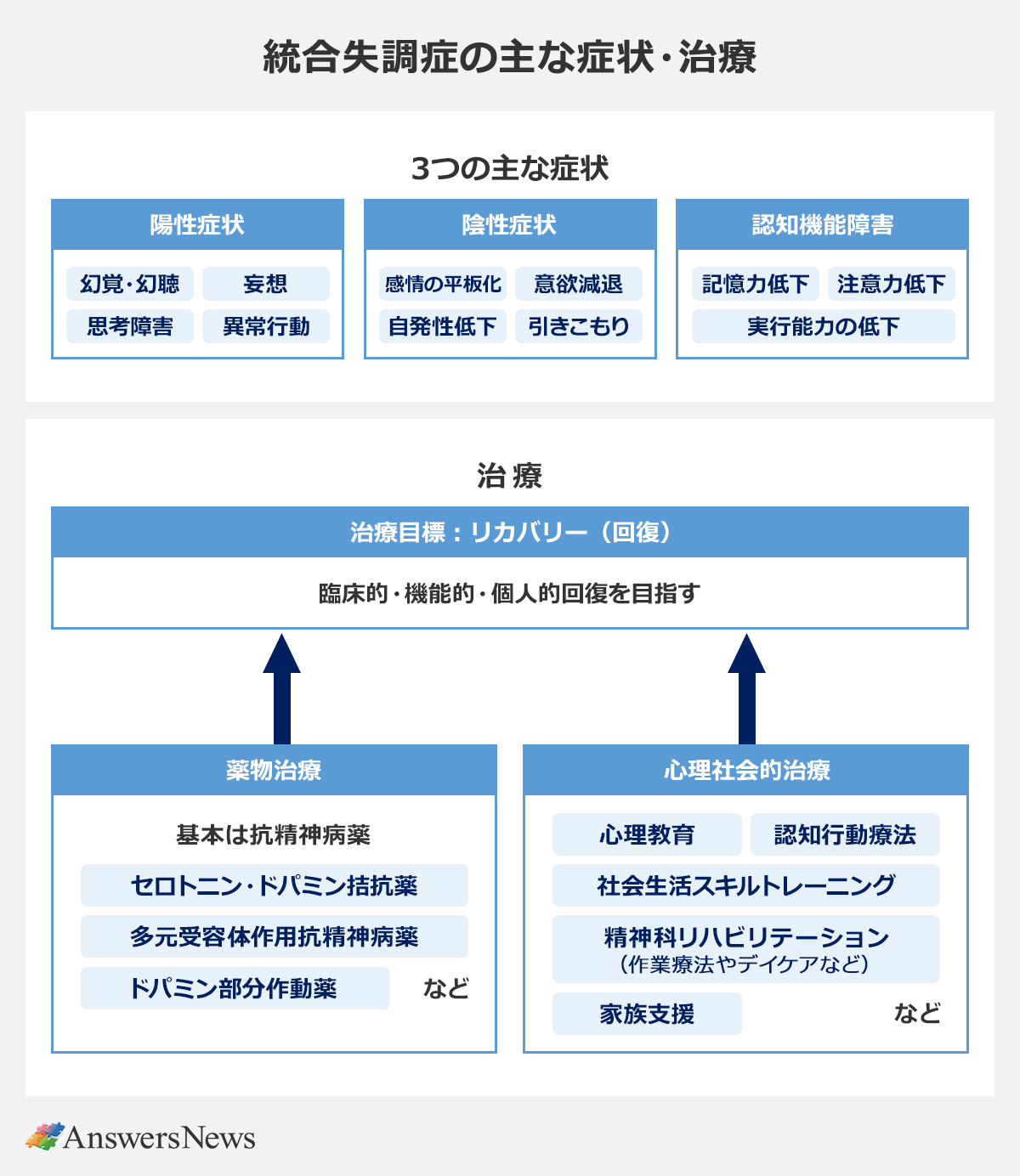
薬物治療の基本は抗精神病薬。定型抗精神病薬(第一世代)と非定型抗精神病薬(第二世代)に大別され、現在の第一選択である非定型抗精神病薬は、作用機序に応じて▽セロトニン・ドパミン拮抗薬(リスパダール、ラツーダなど)▽多元受容体作用抗精神病薬(セロクエルなど)▽ドパミン部分作動薬(エビリファイなど)――に分類されます。
これらはいずれもドパミンD2受容体の遮断作用を持ち、中枢神経系でのドパミンの神経伝達を調節することで治療効果を発揮します。一般的には、症状が改善したあとも再発防止のために服用を続ける必要があり、その中で体重増加や代謝異常といった副作用が問題となる場合は少なくありません。
ドパミンD2受容体を直接標的としない統合失調症薬は数十年ぶり
こうした中で昨年9月、米ブリストル・マイヤーズスクイブの新規作用機序を持つ統合失調症治療薬「Cobenfy」が米国で承認されました。
同薬は、ムスカリン性アセチルコリンM1受容体とM4受容体に対するデュアル作動薬xanomelineと、末梢性ムスカリン性受容体拮抗薬trospium chlorideを組み合わせた配合剤。治療効果をもたらすのはxanomelineで、trospium chlorideはxanomelineが中枢神経系以外(末梢神経)に存在するM2やM3に作用するのを抑えます。trospium chlorideの働きにより、xanomelineの単独使用で懸念される消化器系の安全性の問題をクリア。M1とM4はドパミンの合成・放出シグナル伝達に関わることがわかっており、以前から新たなドパミン制御の治療標的として注目されていましたが、ようやく実用化に至りました。ドパミンD2受容体を直接標的としない統合失調症治療薬の承認は、米国では数十年ぶりです。
承認の根拠となった2つの臨床試験では、主要評価項目であるベースラインから5週目までの陽性・陰性症状評価尺度(PANSS)合計スコアをプラセボとの比較で有意に改善。長期有効性と安全性・忍容性を評価した追加の試験では、52週にわたって症状を改善することに加え、体重増加や運動障害といった副作用が見られないことが確認されました。治療負担が少ないこともあり、2030年までに年間25億ドルの売り上げに達するとの予測も出ています。
ネクセラ創製のM4作動薬は今年P3へ
Cobenfyのほかにも、ドパミンD2受容体を直接標的としない治療薬の開発が進んでいます。
ネクセラファーマが創製し、提携先の米ニューロクライン・バイオサイエンシズが開発するM4受容体選択的オルソステリック作動薬「NBI-1117568」(開発コード)は、高い選択性によって消化器症状などの副作用を回避しています。臨床第2相(P2)試験で陽性症状と陰性症状の両方に対する有効性と良好な忍容性が確認され、今年前半にはP3試験を開始する方針。両社は後続の複数のパイプラインでも提携しており、このうちM1/M4デュアル作動薬「NBI-1117570」は今年後半に統合失調症でP2試験を開始する見通しです。
ネクセラはこのほか、自社創製のGPR52受容体作動薬「NXE0048149」のP1試験を進めています。GPR52受容体は、脳内の陽性症状に関連する領域(線条体)と陰性症状・認知機能障害を引き起こす領域(前頭前皮質)に存在しており、同薬はGPR52を活性化することで線条体ではD2アンタゴニスト様作用、前頭葉ではD1アゴニスト様作用をもたらします。陽性症状、陰性症状、認知機能障害に対して同時に効果が見込めると期待され、昨年3月に独ベーリンガーインゲルハイムとオプション契約を締結。順調に進めば今年のP1終了後、ベーリンガーがオプション権を行使するかどうか判断します。

大塚製薬のTAAR1アゴニスト・ウロタロントも、D2を直接標的としない統合失調症治療薬として開発されている新薬候補の1つ。TAAR1は中枢神経系に存在し、ドパミン、セロトニン、グルタミン酸のシグナル伝達に影響することが知られています。
ウロタロントは23年にP3試験に一度失敗し、創製元の住友ファーマは共同開発から降りましたが、大塚が開発を継続。先月、追加のP3試験を開始しました。28年までの発売を目指しており、大うつ病や全般不安症を含めてピーク時売上高は2000億円を超えると期待しています。
EAファーマ「腸脳相関」に期待
田辺三菱製薬が創製し、米ミネルバ・ニューロサイエンスに導出した「MT-210」は、セロトニン2A/シグマ2受容体拮抗薬。陰性症状を対象に米国で申請していましたが、昨年2月に米FDA(食品医薬品局)が「データが不十分」として承認を見送りました。ミネルバはFDAとの協議を続け、今後の可能性を検討しています。
EAファーマは昨年12月、伊ニューロン・ファーマシューティカルズから、治療抵抗性・治療効果不十分な統合失調症の治療薬evenamideの日本とその他アジア地域(タイやシンガポールなど10カ国)の権利を取得しました。同薬はグルタミン酸調節を介した作用機序を有し、抗精神病薬との併用療法として、ニューロンが行ったピボタル試験で効果が確認されています。消化器領域に強みを持つEAファーマは「精神領域と消化器領域は腸脳相関や併発症状の観点で関係が深い」とし、早期に国内P3試験を開始する方針です。
相次ぐ開発失敗「プラセボ効果」も一因
新薬開発が活発化する一方、臨床試験で有効性を示せず、開発を中止するケースも相次いでいます。
米アッヴィは昨年11月、M4受容体選択的ポジティブアロステリックモジュレーター・emraclidineについて、統合失調症を対象とした単剤療法のP2試験で主要評価項目を達成できなかったと発表。87億ドルを投じた米セレベル・セラピューティクス買収で獲得した2つの新薬の1つでしたが、これを受け、アッヴィは24年12月期決算に35億ドルの減損損失を計上しました。統合失調症の適応では単剤療法でのP3試験への移行を取りやめ、補助療法としての今後の開発を検討しています。
今年1月には、ベーリンガーが認知機能障害を対象に開発していたグリシントランスポーター1(GlyT1)阻害薬イクレペルチンのP3試験に失敗したことを発表。長期の継続試験を含めて開発を中止しました。
武田薬品工業が創製したDAAO阻害薬luvadaxistatは、認知機能障害を対象に開発を進めていたニューロクラインが昨年9月、2本目のP2試験で主要評価項目を達成できなかったと発表。ネクセラとの提携品などに開発リソースを集中させるとし、luvadaxistatは現時点での開発を中止しました。
統合失調症治療薬の開発では、対照群のプラセボ効果が有効性の評価を難しくする1つの要因になります。大塚は失敗したウロタロントの最初のP3試験について「プラセボ群で大きな改善が観察され、有効性をマスクした可能性がある」とし、アッヴィもemraclidineの主要評価未達の理由としてプラセボ効果を挙げています。
ネクセラは、提携先が今年P3試験を始めるNBI-1117568について、24年12月期の決算説明会で「Cobenfyが承認されたことでプラセボ効果も高まる傾向はあると思う。慎重にサイトを選び、試験デザインを組んでいく必要があるが、そのことは(提携先の)ニューロクラインもよくわかっているだろう」と話しました。
AnswersNews編集部が製薬企業をレポート
あわせて読みたい
オススメの記事
-

ウルトラジェニクス、LC-FAOD治療薬トリヘプタノインを申請/MSD、21価肺炎球菌ワクチン「キャップバックス」承認 など|製薬業界きょうのニュースまとめ読み(2025年8月8日)
-

製薬業界 2025年下半期の転職市場トレンド予測―求人数は上半期から横ばいの見通し…メディカルやバイオベンチャーの研究などで募集活発
-

【工場探訪:くすりづくりの現場を歩く】中外製薬工業・宇都宮工場―日本最大級のバイオ医薬品製造施設はDXの先進地
-

【2025年版】国内製薬会社ランキング―トップ3は今年も武田・大塚・アステラス、海外好調で軒並み増収
-

【2025年版】製薬会社世界ランキング―トップ3はロシュ、メルク、ファイザー…リリーがトップ10入り











