
欧米から遅れること6年、新たながん治療として期待される「腫瘍溶解性ウイルス」が国内市場に登場しました。第1号となったのは第一三共の「デリタクト」で、今月1日から販売を開始。ほかにも、タカラバイオなどが臨床試験を進めており、開発が活発化しています。
脳腫瘍での承認は世界初
第一三共は11月1日、腫瘍溶解性ウイルス製剤「デリタクト注」(一般名・テセルパツレブ)を発売したと発表しました。同社が東京大医科学研究所の藤堂具紀教授と共同開発し、今年6月、脳腫瘍の一種である悪性神経膠腫を対象とした再生医療等製品として条件・期限付き承認を取得。腫瘍溶解性ウイルスの承認は国内初で、悪性神経膠腫での承認は世界でも初めてです。
腫瘍溶解性ウイルスは、がん細胞だけで増殖するウイルスで、増殖によってがん細胞を破壊するとともに、破壊されたがん細胞から放出されたがん抗原が免疫を活性化することで抗腫瘍効果を発揮します。もとになるウイルスは、アデノウイルスや単純ヘルペスウイルス、ワクシニアウイルスなど。多くの場合、人為的な遺伝子改変を加えて作られますが、自然変異したウイルスを使うものもあります。デリタクトは、単純ヘルペスウイルス1型の3つの遺伝子に改変を施し、がん細胞でしか増殖できないようにすると同時に、抗腫瘍免疫を強く刺激するよう設計されています。

世界で開発活発化
ウイルスでがんを叩くというアイデア自体は古くからありましたが、遺伝子工学技術の進歩を背景に、近年、開発が活発化しています。欧米では2015年、米アムジェンの「IMLYGIC」(talimogene laherparepvec)が悪性黒色腫を対象に先進国初の腫瘍溶解性ウイルス製剤として承認を取得。米メルクは18年の豪Viralytics買収でコクサッキーウイルスA21型を使った腫瘍溶解性ウイルス製剤をパイプラインに加え、悪性黒色腫、乳がん、皮膚扁平上皮がん、頭頸部扁平上皮がんなどを対象に臨床第2相(P2)試験を進めています。独ベーリンガーインゲルハイムも同年、豪ViraTherapeuticsを買収し、水疱性口内炎ウイルスを使った腫瘍溶解性ウイルス製剤を獲得しました。
デリタクトが対象とする悪性神経膠腫の国内罹患数は年間2800人程度。中央社会保険医療協議会(中医協)の資料によると、ピーク時に年間208人への投与を見込んでいます。薬価は1mL1瓶143万1918円で、ピーク時の予測販売額は年間12億円。世界に先駆けて日本で実用化を目指す医薬品を承認審査で優遇する「先駆け審査指定制度」の対象に指定されており、薬価算定では先駆け審査指定制度加算(10%)がつきました。
ライセンス解消のオンコリス 自力で24年の申請目指す
デリタクトに続く腫瘍溶解性ウイルスとして国内で開発が進められているのが、オンコリスバイオファーマの「OBP-301」(suratadenoturev、通称・テロメライシン)やタカラバイオと大塚製薬の「TBI-1401」(canerpaturev)など。アムジェンはIMLYGICの臨床第1相(P1)試験を日本で行っています。
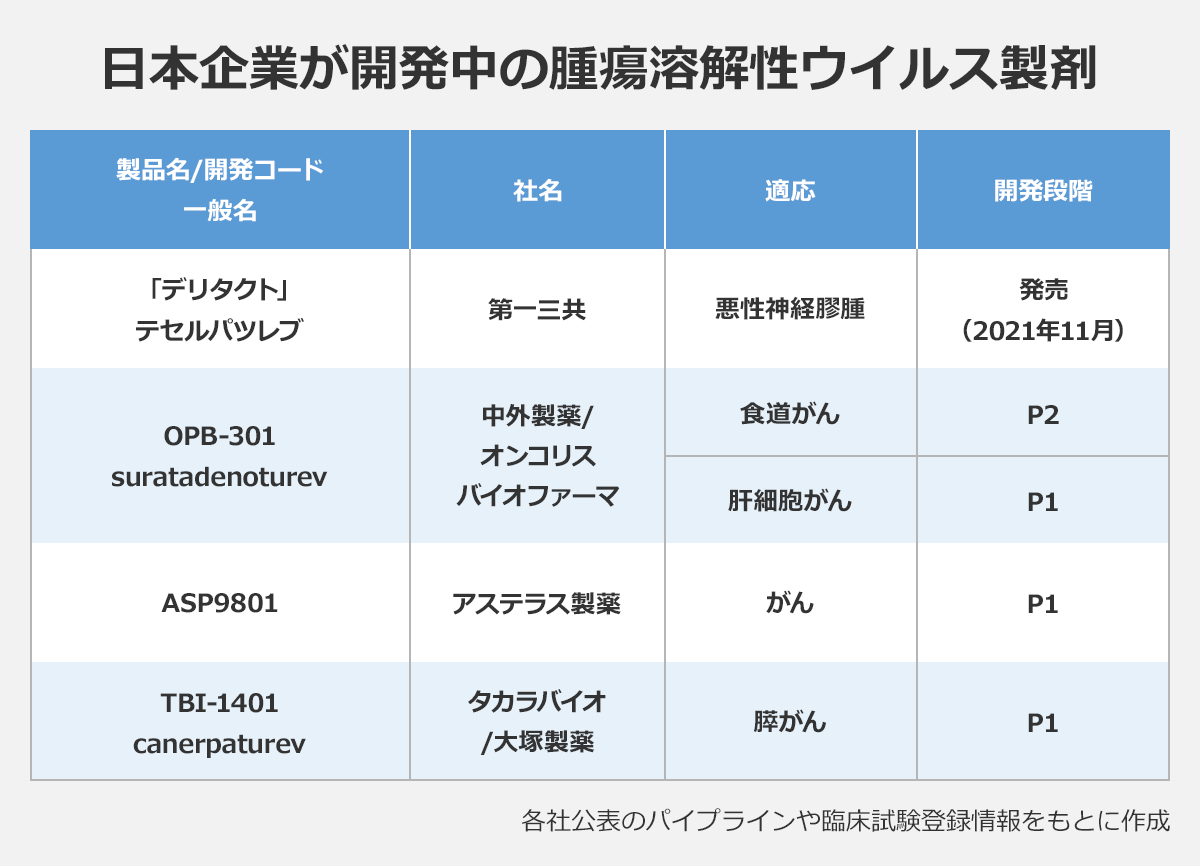
オンコリスのOBP-301はアデノウイルス5型を使った腫瘍溶解性ウイルスで、国内では現在、食道がんに対する放射線療法との併用療法を評価する臨床第2相(P2)試験と、肝細胞がんを対象に免疫チェックポイント阻害薬アテゾリズマブと抗がん剤ベバシズマブを併用するP1試験を行っています。オンコリスは19年に中外製薬とライセンス契約を結び、2つの試験は中外によって行われていますが、両社は今年10月、「協業によって開発を進めることが製品価値最大化につながらない」として契約解消に合意。最長で来年10月まで続く契約期間中は中外が試験を続けますが、その後の開発はオンコリスに引き継がれ、同社は自力で2024年の承認申請を目指す考えです。
タカラバイオは膵がんでP1
タカラバイオと大塚のTBI-1401は、単純ヘルペスウイルス1型の弱毒化株。自然変異したウイルスで、遺伝子工学的な改変は施されていません。国内では16年に締結したライセンス契約に基づいて両社で共同開発を行っており、現在、膵がんの適応でP1試験の段階にあります。
国内企業ではこのほか、アステラス製薬が鳥取大との共同研究で創出した「ASP9801」のP1試験を米国で実施中。ワクシニアウイルスにIL-7とIL-12を発現する遺伝子を搭載したもので、IL-7とIL-12の働きによって腫瘍免疫の活性化を狙っています。同社は米国と日本、中国での同時開発を予定しており、今後、国内でも臨床試験が始まる見込みです。アステラスは、ワクシニアウイルスを使った腫瘍溶解性ウイルスを手掛ける米国のバイオベンチャーKaliVir Immunotherapeuticsとも、静脈投与が可能な腫瘍溶解性ウイルスの共同開発・商業化で提携しています。
新たながん治療として期待される腫瘍溶解性ウイルスですが、供給体制には課題があります。デリタクトは当面、治験実施施設に限定した供給となり、第一三共は「一刻も早く安定的な供給体制を整えていく」とコメント。オンコリスのOBP-301も委託先での治験薬供給や製法開発に時間がかかり、申請予定は当初の22年から2年先送りされました。高品質な製品を安定的に製造できる体制の確立が、普及に向けたカギになります。
















