胃がん・食道がんの市場が急拡大しそうです。
背景にあるのは、高額な抗体医薬の相次ぐ登場です。小野薬品工業の「オプジーボ」は近く胃がんへの適応拡大が承認される見通しで、「キイトルーダ」や「バベンチオ」などほかの免疫チェックポイント阻害薬でも開発が進行中。抗EGFR抗体や抗HER2抗体も開発の最終段階に入っています。
米国のコンサルタント会社ディシジョン・リソーシズ・グループは、2026年までの10年間で日本の胃がん・食道がん市場は6倍に成長するとの予測を発表。市場拡大のスピードが最も高いがん種の1つになるといいます。
オプジーボ 胃がんサードラインで承認へ
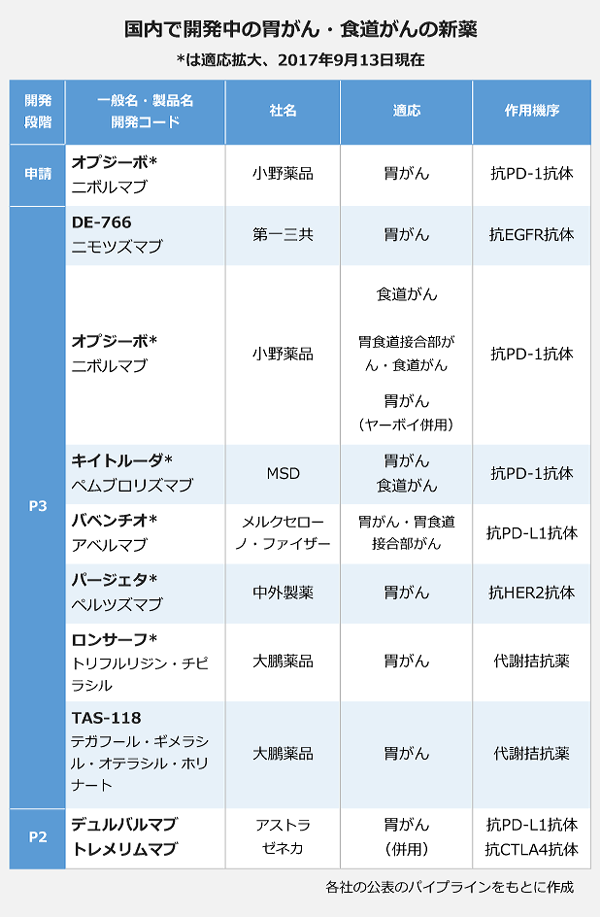
厚生労働省の薬事・食品衛生審議会医薬品第二部会は9月8日、小野薬品工業の抗PD-1抗体「オプジーボ」(一般名・ニボルマブ)について、胃がんへの適応拡大を了承しました。適応は「がん化学療法後に増悪した治癒切除不能な進行・再発の胃がん」。2つ以上の化学療法歴のある患者が対象で、いわゆるサードラインの位置付けとなります。1カ月程度で正式に承認される見通しです。
国立がん研究センターがん情報サービスによると、国内の胃がん患者数は13万2159人(地域がん登録全国推計によるがん罹患データ、2012年)、死亡者数は4万6679人(人口動態推計によるがん死亡データ、15年)。患者数では大腸がんに次いで2番目、死亡者数では肺がん、大腸がんに次いで3番目に多いがんです。
胃がんへの適応拡大が正式に承認されれば、「オプジーボ」の適応は6つ目。14年に悪性黒色腫で承認されたあと、15年に非小細胞肺がんに適応が広がり、投与患者は一気に増えました。近く承認される「胃がんサードライン」の適応拡大により、新たに数千人が「オプジーボ」の投与対象になるとみられます。
市場拡大、牽引役は免疫チェックポイント阻害薬
「オプジーボ」の適応拡大は、胃がん治療薬の市場拡大にドライブをかけることになりそうです。
米国のコンサルタント会社ディシジョン・リソーシズ・グループは今月、2016~26年の10年間で、胃がん・食道がんの市場規模が主要7カ国で7倍、日本では6倍に拡大するとの予測を発表しました。新薬の発売が相次ぎ、数あるがん種の中で最も成長スピードが速い市場の1つとなるといいます。
「キイトルーダ」「バベンチオ」もP3
市場の拡大を牽引するのは、免疫チェックポイント阻害薬です。
胃がんでは「オプジーボ」のほか、MSDの抗PD-1抗体「キイトルーダ」(ペムブロリズマブ)が臨床第3相(P3)試験を実施中。メルケル細胞がんを対象に11月の発売が見込まれるメルクセローノとファイザーが共同開発する抗PD-L1抗体「バベンチオ」(アベルマブ)も胃腺がん・胃食道接合部腺がんを対象にP3試験を行っています。
「オプジーボ」はブリストル・マイヤーズスクイブの抗CTLA-4抗体「ヤーボイ」(イピリムマブ)との併用でもP3試験が進んでおり、アストラゼネカも抗PD-L1抗体デュルバルマブと抗CTLA-4抗体トレメリムマブの併用療法のP2試験を行っています。
これまで殺細胞性の薬剤しか存在しなかった食道がんでも、免疫チェックポイント阻害薬の開発が進みます。「オプジーボ」と「キイトルーダ」がともにP3試験を実施中です。ディシジョン・リソーシズ・グループのアナリスト、ポール・ウィルコック氏は「食道がんで初めて承認される非細胞毒性型薬剤『キイトルーダ』が第2選択薬として19年に承認が予測され、期待が高まる」とコメント。これまで分子標的薬のなかった食道がんに免疫チェックポイント阻害薬が使えるようになることで「食道がん治療は今後10年で大きく改善されるだろう」とみています。
ギリアドのandecaliximabに注目 第一三共のADCも後期段階に
胃がんや食道がんで開発が進むのは、免疫チェックポイント阻害薬だけではありません。
日本企業では、第一三共の抗EGFR抗体ニモツズマブがP3試験を実施中。中外製薬も、乳がんの適応で販売されている抗HER2抗体「パージェタ」(ペルツズマブ)の胃がんへの適応拡大に向けたP3試験を進めており、2018年の申請を予定しています。
ニモツズマブはシンガポールのInnoCIMAbが創製したもので、第一三共は日本での開発・販売権を保有しています。13年に肺がんと胃がんを対象にP3試験を開始しましたが、肺がんでは安全性の問題から14年にP3試験を中止。胃がんのP3試験は継続しており、第一三共は20年度の承認・発売を目指しています。
第一三共はさらに、期待をかける抗体薬物複合体(ADC)「DS-8201」でも、17年度下半期(17年10月~18年3月)にP2試験を始める予定です。
胃がん・食道がんの分野で免疫チェックポイント阻害薬とともに特に注目されるのが、米ギリアド・サイエンシズが開発中andecaliximab。がんの転移や浸潤に関与しているマトリックスメタロプロテアーゼ9を阻害する新規の作用機序を持つ薬剤です。
海外では胃がんを対象にP3試験が進行中。日本法人のホームページに掲載されているパイプラインにはまだ記載はありませんが、米国立衛生研究所(NIH)が運営する臨床試験データベース「ClinicalTrials.gov」によると、胃腺がん・胃食道接合部腺がんを対象に日本でP1試験が行われているようです。
大日本住友製薬がボストン・バイオメディカル買収で獲得したがん幹細胞阻害薬ナパブカシンが、胃がんを対象としたP3試験に失敗するなど、多くの新薬候補が開発中止の憂き目に遭ってきた胃がん・食道がん。開発後期段階に控える品目は、この分野に光をもたらすことになるのでしょうか。開発の成否が注目されます。
【AnswersNews編集部が製薬会社を分析!】 |