
(写真:ロイター)
2025年4月に米FDA(食品医薬品局)が承認した主な新薬と適応拡大を、領域別にまとめました。
INDEX
【新薬】新日本科学の片頭痛治療薬「Atzumi」承認
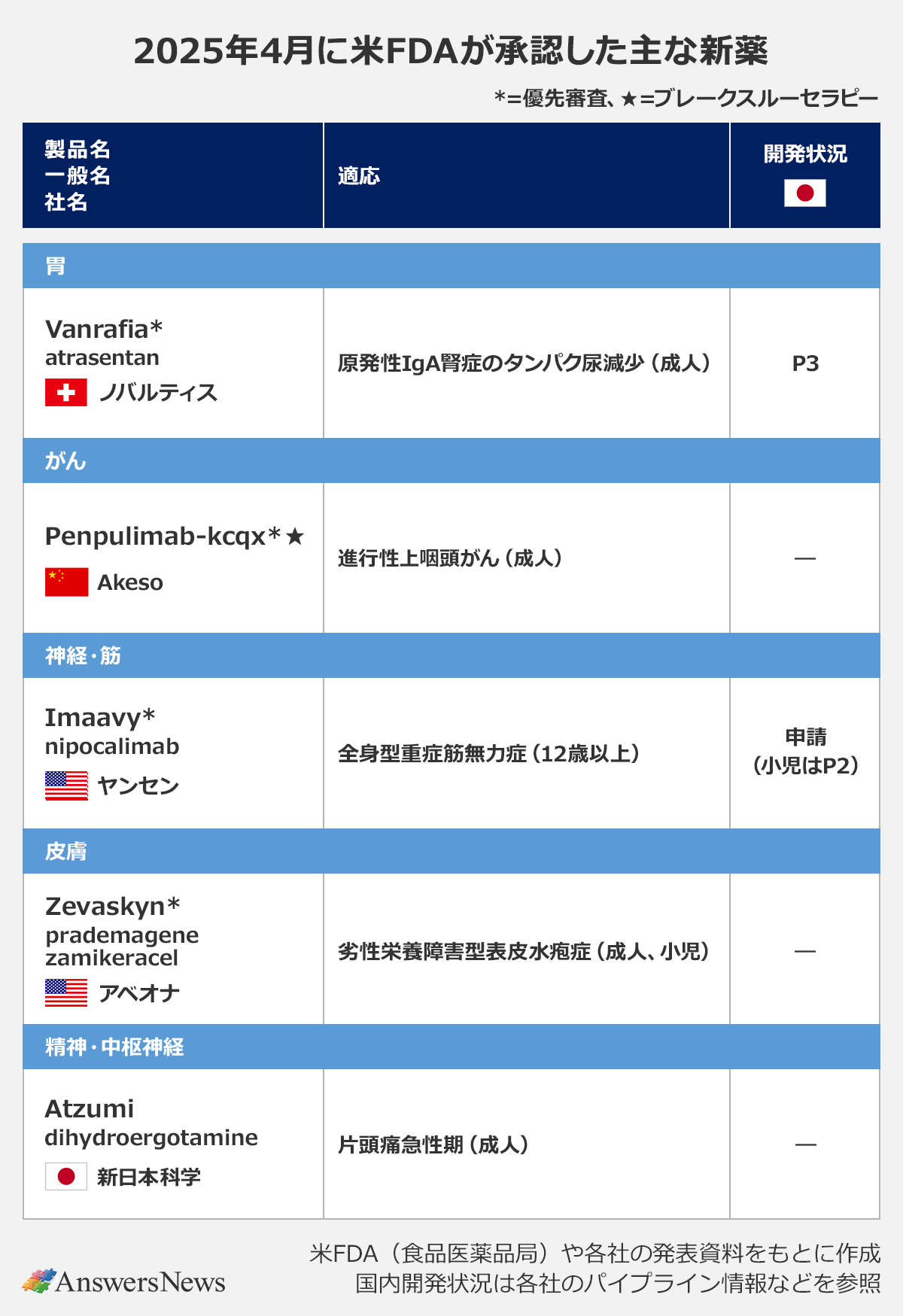
[腎] Vanrafia|スイス・ノバルティス
選択的エンドセリンA受容体拮抗薬「Vanrafia」(一般名・atrasentan)は、進行リスクの高い原発性IgA腎症のタンパク尿減少の適応で迅速承認を取得。RAS阻害薬を含むほかの支持療法にシームレスに上乗せすることができます。IgA腎症では、持続性タンパク尿を有する患者の最大50%が10~20年で腎不全に進行するとされ、承認の根拠となった臨床第3相(P3)試験の中間解析では、投与36週時点でプラセボと比較してタンパク尿の減少を確認。日本でもP3試験の段階にあります。
[がん]Penpulimab-kcqx|中国Akeso
抗PD-1抗体Penpulimab-kcqxは、上咽頭がん(NPC)治療薬として承認されました。適応は、▽再発・転移性非角化NPCの1次治療に対するcisplatinまたはcarboplatinとgemcitabineとの併用療法▽プラチナベース化学療法による治療中または治療後に進行した転移性非角化NPCの2次治療以降に対する単剤療法――。中国では2021年にホジキンリンパ腫治療薬として承認され、NPCの適応でも今年、承認を得ています。
[神経・筋] Imaavy|米ヤンセン
抗FcRn抗体「Imaavy」(nipocalimab)は全身型重症筋無力症治療薬。抗AChR抗体陽性または抗MuSK抗体陽性の12歳以上の患者が対象です。標準治療への上乗せ効果を検証した成人対象のP3試験では、日常生活動作を評価するスコアをプラセボに比べて有意に改善。持続的な病勢コントロールを示しました。日本でも同試験の結果をもとに今年1月に申請しており、小児を対象とするP2試験が進行中です。
[皮膚]Zevaskyn|米アベオナ
「Zevaskyn」(prademagene zamikeracel)は、劣性栄養障害型表皮水疱症に対する初の遺伝子治療薬です。同疾患は、真皮と基底膜の接着を担う7型コラーゲンを産生できない重篤な皮膚疾患。Zevaskynは、7型コラーゲンを産生するCOL7A1遺伝子をレトロウイルスベクターを使って患者の皮膚細胞に組み込んだシート状の遺伝子治療薬で、創傷部位に貼付します。標準治療を対照群として行ったP3試験では、1回の治療で顕著な創傷治癒と疼痛軽減が確認されました。
[精神・中枢神経]Atzumi|新日本科学
「Atzumi」は、片頭痛急性期治療薬dihydroergotamineの経鼻薬。点鼻粉末製剤と経鼻投与デバイスを組み合わせた新日本科学独自の技術を活用して開発されました。鼻粘膜での薬物滞留を向上させることで、速やかかつ高い薬物吸収を狙っています。従来の注射剤や点鼻スプレーと薬物動態を比較したP1試験や、長期の安全性を評価したP3試験の結果に基づいて承認されました。
【適応拡大】「Uplizna」のIgG4関連疾患や「Dupixent」の慢性特発性蕁麻疹

がん
Opdivo|米ブリストル・マイヤーズスクイブ
抗PD-1抗体「Opdivo」(nivolumab)は、抗CTLA-4抗体「Yervoy」(ipilimumab)との併用療法が、▽高頻度マイクロサテライト不安定性(MSI-H)またはミスマッチ修復機構欠損(dMMR)を有する治癒切除不能な進行・再発の結腸・直腸がんの1次治療▽切除不能または遠隔転移を有する肝細胞がんの1次治療――の2つの適応で新たに承認されました。結腸・直腸がんの適応では、P3試験で化学療法と比べて病勢進行または死亡リスクを79%抑制。肝細胞がん対象のP3試験では、チロシンキナーゼ阻害薬と比べて全生存期間を延長しました。両適応とも欧州で承認済み。日本でも申請中です。
Vitrakvi|独バイエル
TRK阻害薬「Vitrakvi」(larotrectinib)は、「NTRK融合遺伝子陽性の固形がん」の適応で完全承認を取得しました。対象は、▽転移性または外科的切除で重篤な合併症を引き起こす可能性がある▽代替治療法がない、または前治療後に病勢進行した――患者。同薬は2018年11月に迅速承認を取得していました。
免疫
Uplizna|米アムジェン
抗CD19抗体「Uplizna」(inebilizumab)は、免疫グロブリンG4(IgG4)関連疾患に適応拡大。同疾患はさまざまな臓器に影響を及ぼす可能性のある慢性の炎症性疾患で、寛解期と予測不能な再発期があることが知られています。承認の根拠となったP3試験では、プラセボに比べて再発リスクを87%抑制しました。日本では導出先の田辺三菱製薬が適応拡大を申請中です。
Rinvoq|米アッヴィ
JAK阻害薬「Rinvoq」(upadacitinib)は、巨細胞性動脈炎に適応拡大。ステロイド漸減投与との併用を検証したP3試験では、主要評価項目である12週から52週までの寛解維持を達成しました。同適応では、欧州でも今年4月に承認。日本でも申請中です。
皮膚
Dupixent|米リジェネロン・ファーマシューティカルズ
抗IL-4/IL-13受容体抗体「Dupixent」(dupilumab)は、慢性特発性蕁麻疹に適応拡大しました。同疾患に対する標的治療薬は米国では10年以上ぶり。承認の根拠となった臨床試験では、プラセボに比べて痒みと蕁麻疹スコアを有意に軽減しました。日本では24年2月に承認されています。欧州では申請中です。
循環器・代謝
Isturisa|イタリア・レコルダティ
副腎皮質ホルモン合成阻害薬「Isturisa」(osilodrostat)は、適応症を「クッシング症候群に伴う内因性高コルチゾール血症」に変更しました。対象は手術の選択肢がない、治癒にいたらない成人患者。同薬は20年、クッシング症候群のうち、コルチゾールの過剰がACTHの過剰に起因するものを指す「クッシング病」を対象に承認されましたが、350人を超える患者を対象とする臨床開発プログラムをもとに適応を拡大しました。
Eliquis|米ブリストル
抗凝固薬「Eliquis」(apixaban)は、生後5日以降の小児患者の静脈血栓塞栓症に適応拡大。治療または再発リスクの低減を目的として使用されます。同適応で使用できる経口液剤も承認されました。
神経・筋
Valtoco|米Neurelis
「Valtoco」は、2020年に承認された抗てんかん薬diazepamの点鼻スプレー製剤。2歳以上6歳未満の小児に対象を拡大しました。日本では導出先のアキュリスファーマが成人を含め申請中です。
【バイオシミラー】バイオコンのbevacizumab

Jobevne|インド・バイオコン
「Jobevne」は、抗がん剤「Avastin」(bevacizumab)のバイオシミラー。欧州とカナダでも承認されています。














