
(写真:ロイター)
2025年6月に米FDA(食品医薬品局)が承認した主な新薬と適応拡大を、領域別にまとめました。
【新薬】豪CSLのHAE治療薬「Andembry」など
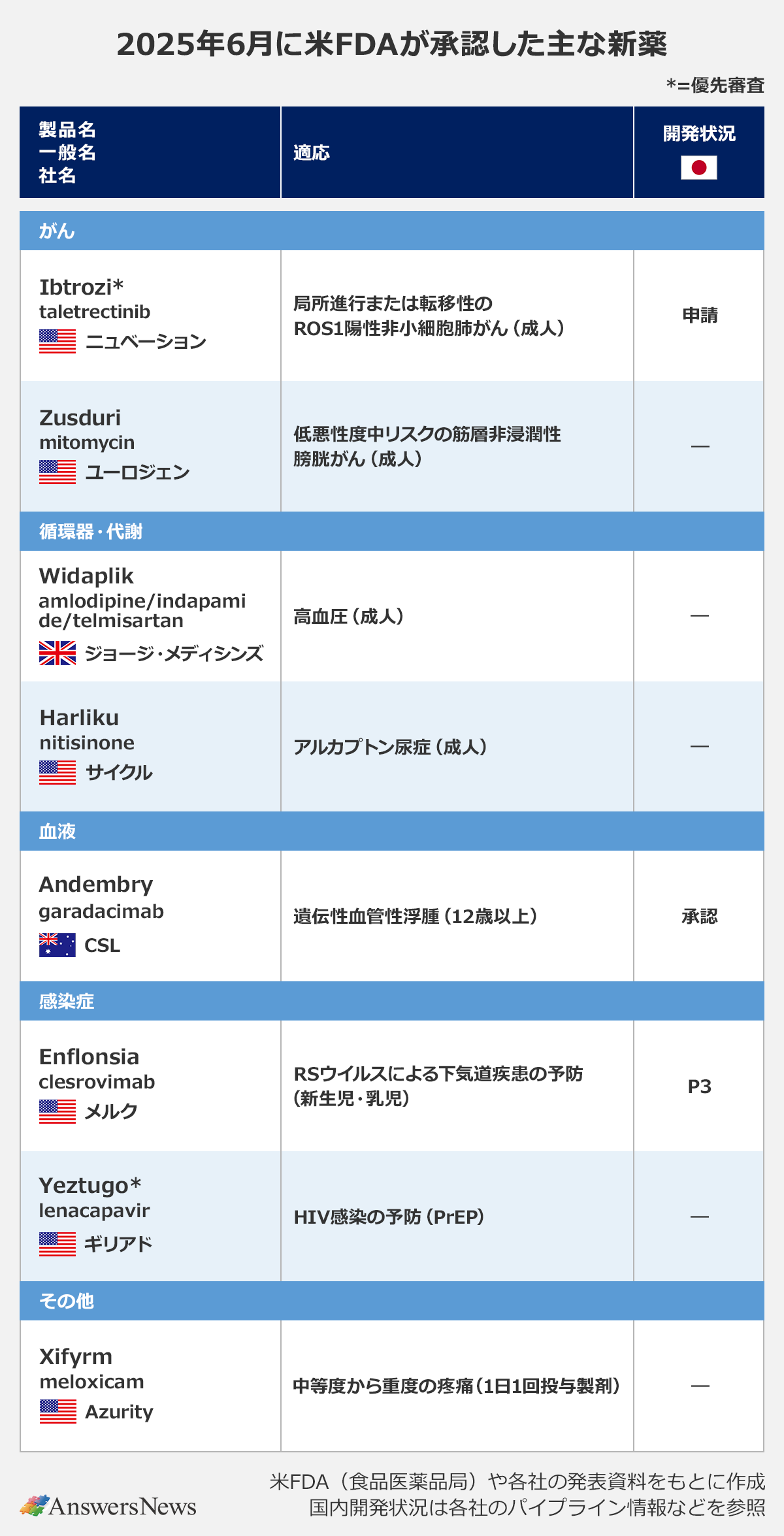
がん
Ibtrozi|米ニュベーション
ROS1阻害薬「Ibtrozi」(一般名・taletrectinib)は、「局所進行または転移性のROS1融合遺伝子陽性非小細胞肺がん(NSCLC)」の適応で承認を取得。NSCLCでは約2%の患者がROS1融合遺伝子陽性とされています。承認の根拠となった2つの臨床第2相(P2)試験では、持続的で高い奏効率を示したほか、ROS1陽性NSCLCにしばしば見られる脳転移を有する患者で頭蓋内奏功が確認されました。中国でも承認済みで、日本では導出先の日本化薬が今年3月に申請しました。
Zusduri|米ユーロジェン
「Zusduri」は、抗がん剤mitomycinの膀胱内注入液。低悪性度中リスクの筋層非浸潤性膀胱がん(LG-IR-NMIBC)の適応で承認されました。ユーロジェン独自の持続放出性ハイドロゲル基剤技術を使った新規製剤で、外来治療で尿道カテーテルを使って膀胱内に直接投与する非外科的治療。P3試験では投与3カ月時点で78%の患者が完全奏効しました。LG-IR-NMIBCの標準治療は経尿道的膀胱腫瘍切除術で、再発すると再手術が必要となることが知られています。
循環器・代謝
Widaplik|英ジョージ・メディシンズ
「Widaplik」はカルシウム拮抗薬amlodipine、利尿降圧薬indapamide、アンジオテンシンII受容体拮抗薬(ARB)telmisartanの配合剤。対象疾患は高血圧症で、初期治療にも使用可能です。臨床試験では、2剤併用療法やプラセボと比べて血圧を有意に下げました。
Harliku|米サイクル・ファーマシューティカルズ
HPPD阻害薬「Harliku」(nitisinone)は、先天性代謝異常症のアルカプトン尿症の治療薬。アルカプトン尿症の患者ではホモゲンチジン酸(HGA)の尿中への排泄が増えますが、同薬は尿中のHGAを減少させる作用を持ちます。同疾患に対する治療薬は米国初。nitisinoneはチロシン血症治療薬としても知られ、サイクルは17年に「Nityr」の製品名で遺伝性チロシン血症1型の治療薬としての承認を取得しています。
血液
Andembry|豪CSL
「Andembry」(garadacimab)は、遺伝性血管性浮腫(HAE)に対する抗体医薬。HAEでは、血液凝固第XII因子(FXII)の活性化によって血管性浮腫を引き起こす一連の反応が始まりますが、同薬は活性化したFXII(FXIIa)を標的することで反応の最上流を阻害します。臨床試験ではプラセボと比較して有意にHAE発作を減少。日本と欧州では今年2月に承認されています。
感染症
Enflonsia|米メルク
「Enflonsia」(clesrovimab)は、RSウイルス感染症予防のための抗RSウイルス抗体。最初の感染流行期を迎える新生児や乳児のRSウイルスによる下気道疾患を防ぎます。承認の根拠となったP2/3試験では、RSウイルス感染症の発生率と入院率が有意に低下。欧州でも申請中で、日本ではP3試験段階にあります。
Yeztugo|米ギリアド
カプシド阻害薬「Yeztugo」(lenacapavir)は、暴露前予防内服(PrEP)に使用できるHIV感染予防薬。年2回の皮下投与で済むのが特徴で、服薬アドヒアランスの改善につながると期待されています。HIV治療薬としては22年に米欧で、23年に日本で「Sunlenca」の製品名で承認済み。欧州でも予防薬として申請中です。
【適応拡大】「Datroway」のEGFR変異陽性非小細胞肺がんなど
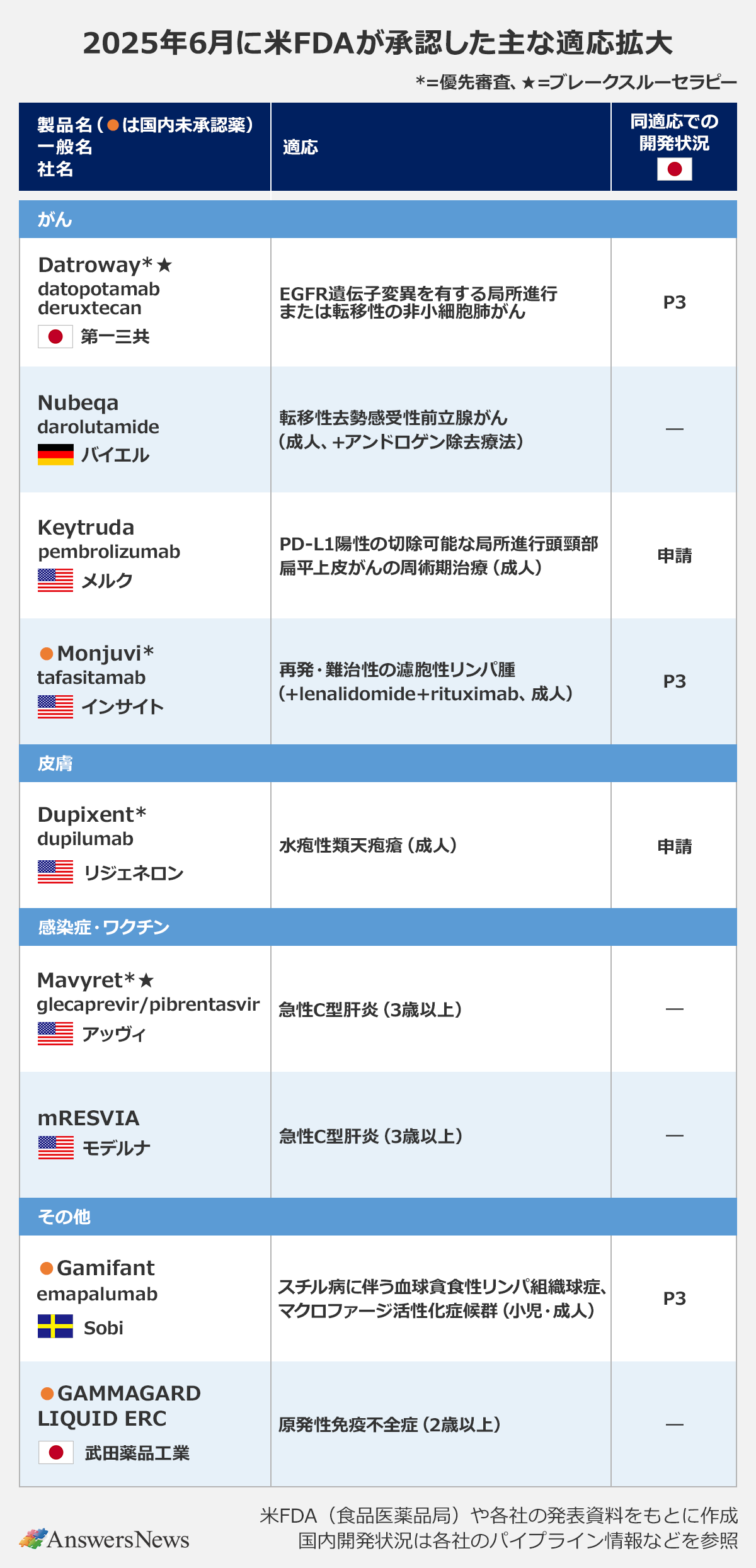
がん
Datroway|第一三共
抗TROP2抗体薬物複合体(ADC)「Datroway」(datopotamab deruxtecan)は、新たに「EGFR遺伝子変異を有する局所進行または転移性の非小細胞肺がん」の適応で迅速承認を取得しました。対象は、EGFR標的療法とプラチナベースの化学療法の前治療歴のある患者で、肺がんに対する抗TROP2療法は米国初。日本ではP3試験が進行中です。
Nubeqa|独バイエル
アンドロゲン受容体阻害薬「Nubeqa」(darolutamide)は、転移性去勢感受性前立腺がんに対するアンドロゲン除去療法(ADT)との併用療法が承認されました。ADTに対する上乗せを検証した臨床試験では、プラセボと比べて放射線学的進行や死亡のリスクを46%減少。Nubeqaは従来、ADTと化学療法のdocetaxelとの併用療法で承認されていましたが、今回の承認で化学療法の併用を問わずに使用できるようになりました。欧州でも近く承認される見通しです。
Keytruda|米メルク
抗PD-1抗体「Keytruda」(pembrolizumab)は、新たに「PD-L1陽性の切除可能な局所進行頭頸部扁平上皮がん」に対する周術期治療が承認されました。術前療法としての単剤療法を行ったあと、アジュバント療法として放射線療法および必要に応じてcisplatinと併用し、その後は単剤で使用します。P3試験では、標準治療に比べて無イベント生存期間を有意に延長しました。日本と欧州でも申請中です。
Monjuvi|米インサイト
Fc修飾細胞溶解性抗CD19抗体「Monjuvi」(tafasitamab)は、再発・難治性の濾胞性リンパ腫に適応拡大。免疫調整薬lenalidomide、抗CD20抗体rituximabと併用します。2剤への上乗せを検証した臨床試験では、無増悪生存期間を有意に改善。日本も同試験に参加しています。
皮膚
Dupixent|米リジェネロン
抗IL-4/13受容体抗体「Dupixent」(dupilumab)は、新たに水疱性類天疱瘡の適応で承認を取得しました。水疱性類天疱瘡は主に高齢者に見られる、かゆみや水疱を特徴とする皮膚疾患。プラセボ対照のP2/3試験では、寛解持続やかゆみの軽減、経口コルチコステロイドの使用減少が確認されました。日本と欧州、中国でも申請中です。
感染症・ワクチン
Mavyret|米アッヴィ
抗ウイルス薬「Mavyret」(glecaprevir/pibrentasvir)は、3歳以上の急性C型肝炎に適応拡大。これにより、医師は急性、慢性を問わずにMavyretの処方が可能となり、診断時に直ちに治療を開始できるようになりました。
mRESVIA|米モデルナ
RSウイルスワクチン「mRESVIA」は、新たにRSウイルスによる下気道疾患の発症リスクが高い18歳から59歳までの成人に使用できるようになりました。同ワクチンは米国と欧州で24年、日本では今年5月、60歳以上の成人を対象に承認。59歳未満では、基礎疾患を持つ人が対象となります。
その他
Gamifant|スウェーデンSobi
抗インターフェロン ガンマ(IFNγ)抗体「Gamifant」(emapalumab)は、スチル病に伴う血球貪食性リンパ組織球症(HLH)およびマクロファージ活性化症候群(MAS)に適応拡大。承認の根拠となった臨床試験では、投与後8週時点で患者の54%が完全奏効を達成しました。同薬は18年に原発性HLH治療薬として承認されました。
GAMMAGARD LIQUID ERC|武田薬品工業
「GAMMAGARD LIQUID ERC」は、原発性免疫不全症の補充療法に使用される液状人免疫グロブリン製剤。液状製剤のため溶解操作が不要で、静脈注射または皮下注射が可能。既存の溶解操作不要な液状人免疫グロブリン製剤の中では最もIgA含有量が少ない製剤です。同剤の承認に合わせ、従来低IgA含量免疫グロブリン製剤として提供してきた「GAMMAGARD S/D」の製造は終了する方針です。欧州でも5月に承認されました。















