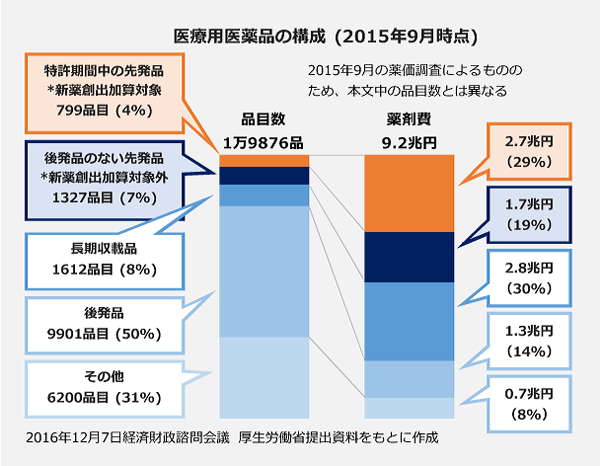
新薬の薬価引き下げを一時的に猶予し、革新的新薬の創出や未承認・適応外薬問題の解消などを後押しする目的で創設された「新薬創出・適応外薬解消等促進加算」に、見直しの圧力が高まっています。
昨年末に政府がまとめた薬価制度改革に向けた基本方針では「ゼロベースで抜本的に見直す」とされ、財務省の審議会は報告書に「廃止」と明記。厚生労働省は、対象品目や加算を受けられる企業の要件を見直すと明言しました。
厚労相「対象品目と企業要件を見直す」
6月の「骨太の方針」とりまとめに向けて議論が佳境に入った政府の経済財政諮問会議。社会保障改革を取り上げた5月23日の会合で塩崎恭久厚生労働相は、
「新薬創出・適応外薬解消等促進加算」は、革新的医薬品がより多く創出される仕組みとなるよう、「対象となる医薬品の範囲」と「企業要件」を見直す
との方針を表明しました。
新薬創出加算は、一定の条件を満たした新薬の薬価に加算を付け、2年に1回の市場実勢価格に基づく薬価引き下げを特許が切れるまで猶予する制度。企業の研究開発投資の回収を早め、革新的新薬の創出と未承認・適応外薬問題やドラッグ・ラグの解消を後押しすることが目的です。2010年度の薬価制度改革で試行的に導入されました。
新薬創出加算をめぐっては、昨年末に政府がまとめた「薬価制度の抜本改革に向けた基本方針」で「ゼロベースで抜本的に見直す」とされ、2018年度の次期薬価制度改革に向けた重要な論点の1つとなっています。
この日の諮問会議では、新浪剛史・サントリーホールディングス社長ら民間出身の議員が「明確な政策効果が上がるよう、革新性のある医薬品に対象を絞り込むなど、その仕組を見直すべき」と提案。これに応える形で塩崎厚労相も対象品目の見直しを表明しました。16年度薬価改定時点で416成分823品目に上る加算対象が縮小するのは決定的です。
財務省 審議会が「廃止」要求
新薬創出加算をめぐっては、制度導入当初から、その対象品目の選定方法に批判的な意見が上がっていました。
「有効性や安全性といった医薬品の価値とは関係なく、ほかの医薬品に比べて市場実勢価格があまり下がっていないということだけで加算の対象となるなど、イノベーションの評価といった観点からも問題の多い仕組みだ」
財務相の諮問機関である財政制度等審議会は5月25日にまとめた建議(報告書)の中で、新薬創出加算の問題点を改めて指摘。「当審議会としては、新薬創出加算は廃止し、国民負担を軽減すべき」との考えを示しました。2010年度の導入以来、繰り返し制度の見直しを要求してきた財政審ですが、毎年2回まとめる建議で廃止にまで踏み込んだのは今回が初めてです。
新薬創出加算は原則として、後発品が発売されておらず、市場実勢価格と薬価の乖離率が全ての医薬品の平均を下回る品目に適用されます。革新的新薬は類似薬が少ない(=競合がなく市場実勢価格が下がりにくい)との考え方ですが、「本当に革新的な医薬品に適用される仕組みになっていない」との指摘は絶えません。
「薬の質というよりは価格で加算が決まっている」「画期的なイノベーションではなく、単なる“ゾロ新”を開発するインセンティブになっているのではないか」――。経済財政諮問会議の下に設置されている経済・財政一体改革推進委員会の社会保障ワーキンググループ(4月11日、同25日)でも厳しい意見が噴出。「加算の対象とするため、実勢価格の値引きを抑えているような流通構造もあるかもしれない」といった声も上がりました。
製薬業界「薬価維持の恒久的仕組み必要」
一方、製薬業界側は、革新的新薬の開発を加速させるためには、特許期間中の新薬の薬価を維持する仕組みが必要と主張します。
5月17日に開かれた中央社会保険医療協議会(中医協)薬価専門部会では、日本製薬団体連合会(日薬連)と米国研究製薬工業協会(PhRMA)、欧州製薬団体連合会(EFPIA)が意見陳述。そろって薬価を維持する恒久的制度の必要性を訴えました。
薬価制度改革の最重要課題
新薬創出加算は、2010年度の導入から“試行”の状態が続いています。恒久制度化は製薬業界にとって、18年度薬価制度改革の最重要課題です。
この日の中医協薬価専門部会では、EFPIAが「少なくとも現行の新薬創出加算制度をそのまま継続し、加算対象となる製品の範囲を維持すべき」と現行制度の維持を主張。日薬連とPhRMAは「新薬創出加算のコンセプトをもとに、特許期間中の新薬の薬価を維持する薬価改定方式を制度化すべき」(日薬連)などと、必ずしも現行制度にはこだわらない姿勢も示しました。
新薬創出加算をめぐっては、その効果に対する疑問を払拭しきれていないことも、恒久制度化を阻む要因となっています。PhRMAの調査によれば、加算の導入後、申請ラグ(欧米と日本の承認申請の時間差)は大幅に短縮し、日本での新薬開発も増加。未承認・適応外薬の解消も進み、一定の効果は出ていると言えます。しかし、数百億円に上る加算額に照らしてどうか、という点ではなかなか理解が得られません。
加算品目の多くを外資系企業の製品が占めていることも、薬価制度改革のたびに議論になってきました。16年度改定で加算を得た品目を企業別に見ると、上位10社に日本企業はアステラス製薬1社のみ。上位20社で見ても、日本企業は7社にとどまります。
予想を超えて大きな売り上げを出した医薬品の薬価を大幅に引き下げる「特例拡大再算定」の導入や、免疫チェックポイント阻害薬「オプジーボ」の薬価引き下げ、そして薬価の毎年改定と、逆風にさらされ続ける製薬業界。それだけに新薬創出加算の制度化は譲れないポイントです。制度の廃止論も飛び出す中、年末の改革案とりまとめに向けて激しい攻防が続くことになります。